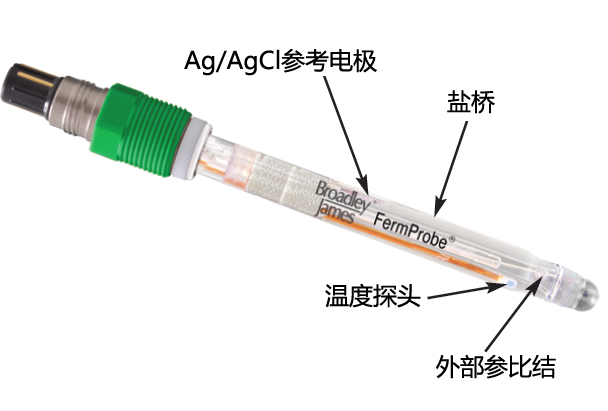
如何测试纯水的pH
使用一般的pH 计来测超纯水,其读值是非常不稳定的。原因如下:
一般性的pH 计皆设计使用在高离子强度的溶液中,而相对的,超纯水却是极度低离子强度的溶液,实际上,市面上有低离子强度溶液专用的电极及灵敏度高的主机,如果不是使用这类型仪器,读值就会有乱跳的现象,十分难以确认。
盐桥阻塞,造成应有功能丧失,导因于电极缺乏保养,而盐桥多是使用疏松多孔的陶磁或铁弗龙材质做成,主要是作为电极内外阴阳离子平衡所用,但因缺乏定期清洁,在低离子强度的溶液下,所测到的超纯水pH多为不合理的偏高,多数在9~11左右,如果遇到这种状况,只要加入一小匙中性盐以提高离子在盐桥上的扩散能力,少有例外的,pH值会在几秒之内掉到pH 7以下,理论上,中性的KCl不会改变pH的,改变的,只是离子强度而已。
一般实验室的pH 计常出现的问题如下
(a) pH标准液经常是过期的
(b)电极不用时,确认浸泡在3M的KCl溶液中
(c)要经常更换电极内的参考电极溶液,否则会引起一连串毛病
结论:
基本上,检测超纯水的pH是无法证明水质好坏,在二氧化碳可影响的pH范围内(pH 7→pH 4.5),任何pH读值仅能表示二氧化碳溶解及碳酸解离的程度,除此之外,不代表任何意义。
如果, pH读值偏碱,表示可能是电极出了问题(电极膜污染或老化,盐桥阻塞,参考液污染等),如果要测超纯水的pH,等同于让pH 计在极限条件下工作,对pH 计的工作能力是极具挑战的。
不建议使用酸度计来证明水质的好坏,因为牵扯的因素太多了,所以以不接触空气的在线方式,检测超纯水的导电度,是准确且稳定的做法,可由实验及化学计算来证明,18.25MΩ.cm的水,其阴/阳离子总量必定低于1ppb,足堪水质指标。

 厦门沃泰科技有限公司
厦门沃泰科技有限公司 扫一扫,手机浏览
扫一扫,手机浏览